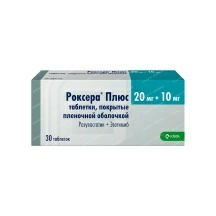
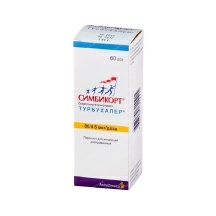
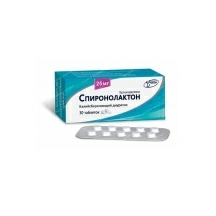
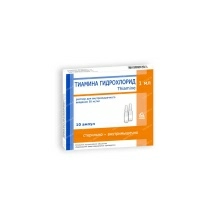
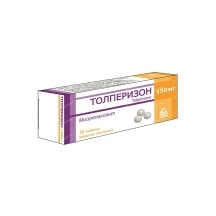
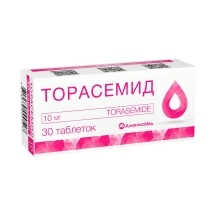
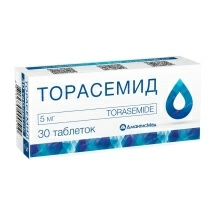
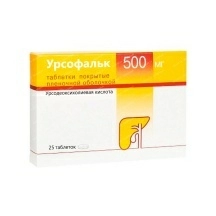
Минск
Ваш город — Минск?
537-50-50 колл-центр МТС, A1, life:)
Время работы колл-центра
Пн - Пт: 9:00 - 20:30
Сб - Вс: 9:00 - 19:00
Сб - Вс: 9:00 - 19:00
Обратный звонок
Меню
Каталог
Каталог
- Лекарственные и профилактические средства
- Антибиотики и противомикробные
- Антисептики и дезинфектанты
- Дерматология
- Желудочно-кишечный тракт
- Женское здоровье
- Костно-мышечная система
- Лекарства при боли и воспалении
- Лекарства при герпесе
- Лекарства при заболеваниях глаз и ушей
- Лекарства при заболеваниях печени
- Лекарства при простуде и гриппе
- Лекарственные средства при аллергии
- Лечение астмы
- Лечение и профилактика геморроя и варикоза
- Мужское здоровье
- Нервная система
- При заболеваниях мочевыводящих путей
- Противогрибковые средства
- Противопаразитарные препараты
- Прочие средства
- Сердечно-сосудистая система
- Стоматологические препараты
- Улучшение мозгового кровообращения
- Фитотерапия (травы, сборы)
- Эндокринная система
- Витамины и БАДы
- Аминокислоты
- Витамин Д
- Витамин С и глюкоза
- Витаминно - минеральные комплексы
- Витамины А и Е
- Витамины и БАДы группы В
- Витамины и БАДы для беременных и кормящих
- Витамины и БАДы для глаз
- Витамины и БАДы для детей
- Витамины и БАДы для диабетиков
- Витамины и БАДы для женщин
- Витамины и БАДы для кожи, волос и ногтей
- Витамины и БАДы для мужчин
- Витамины и БАДы для нормализации работы ЖКТ
- Витамины и БАДы для сердца и сосудов
- Витамины и БАДы для суставов и костей
- Витамины и БАДы при стрессе и повышенных нагрузках
- Гематогены, батончики, леденцы
- Железо
- Кальций
- Магний
- Общеукрепляющие
- Омега-3 и рыбий жир
- Премиум БАД Solgar и Bounty
- Селен
- Цинк
- Красота и уход
- Уход за волосами
- Уход за глазами
- Уход за губами
- Уход за лицом
- Уход за ногами
- Уход за проблемной кожей
- Уход за ресницами и бровями
- Уход за руками
- Уход за телом
- Оптика
- Аксессуары для очков и линз
- Готовые очки
- Капли и гели для глаз
- Контактные линзы
- Растворы для контактных линз
- Солнцезащитные очки
- Дермакосметика
- A-DERMA
- ADC
- Apivita
- Avene
- Antirougeurs - купероз
- Cicalfate - раздражение
- Cleanance - жирная кожа, акне
- Cold cream - очень сухая кожа
- Hydrance - увлажнение
- Physiolift - антивозврастной уход
- Tolerance - аллергенная кожа
- TriAcneal - акне
- Trixera - сухая, чувствительная кожа
- Xeracalm - атопия
- Защита от солнца Avene
- Очищение кожи
- Термальная вода Avene
- Чувствительная кожа
- BABE Laboratorios
- Bioderma
- CeraVe
- Dermastabil
- Dermedic
- Ducray
- ISISPHARMA
- La Roche-Posay
- Anthelios - защита от солнца
- Cicaplast - мультивосстановление кожи
- Effaclar - жирная кожа, акне
- Hyalu B5 - увлажнение, против морщин
- Hydraphase - чувствительная, обезвоженная кожа
- Hydreane - увлажнения, чувствительная кожа
- La Roche-Posay - Дезодоранты
- La Roche-Posay - Очищение лица
- Lipikar - очень сухая кожа, раздражение
- Nutritic - очень сухая кожа
- Redermic - антивозрастной уход
- Retinol - глубокие морщины
- Rosaliac - купероз
- Toleriane - сверхчувствительная кожа
- Vitamin C - антивозрастной уход
- Термальная вода La Roche-Posay
- Lierac
- Louis Widmer
- Noreva
- АКВАРЕВА - увлажнение
- АКТИПЮР - чувствительная, проблемная кожа с несовершенствами
- АЛЬФА КМ - антивозврастной уход
- БЕРГАСОЛ ЭКСПЕРТ- солнцезащитная линейка
- БЕРГАСОЛ СУБЛИМ - средства для активации загара и защита от солнца
- ГЕКСАФАН - уход за волосами
- КСЕРОДИАН - уход за сухой и очень сухой кожей, склонной к атопии
- МАТИДИАН - комбинированная кожа
- НОВЕАН ПРЕМИУМ - антивозврастной уход
- ПСОРИАН - псориаз
- СЕБОДИАН DS - себорейный дерматит
- СЕНСИДИАН - чувствительная, реактивная кожа
- СЕНСИДИАН AR - розацеа, купероз
- ЦИКАДИАН - восстанавливающий уход
- ЭКСФОЛИАК - жирная, проблемная кожа с несовершенствами
- Novexpert
- Hyaluronic Acid line - разглаживание и антивозрастной уход
- Magnesium line - чувствительная кожа
- Omegas line - очень сухая кожа, дерматит
- Polyphenols line - отбеливание
- Pro-collagen line - разглаживание морщин
- Pro-melanin line - пигментация и антивозрастной уход
- Trio-Zinc line - антиакне и антивозрастной уход
- Vitamin C line - сияние и антивозрастной уход
- Oillan
- OLOS
- Pharmaceris
- Pharmaceris A - аллергенная кожа
- Pharmaceris E - очень сухая кожа
- Pharmaceris F - тональные флюиды
- Pharmaceris H - волосы
- Pharmaceris M - Уход за кожей во время беременности и кормления
- Pharmaceris N - капилляры
- Pharmaceris P - псориаз
- Pharmaceris R - розацеа
- Pharmaceris S - солнцезащитный уход
- Pharmaceris T - жирная кожа, акне
- Pharmaceris V - витилиго
- Pharmaceris W - пигментация
- Phyto
- RILASTIL
- Acnestil - жирная кожа, акне
- Age Repair - солнцезащитный уход для возрастной кожи
- Aqua - увлажнение
- D-clar - пигментация
- Daily Care - очищение и демакияж
- Deliskin RS - купероз
- DEO - дезодорант
- Dermastil pediatric - детство
- Difesa - чувствительня, аллергенная кожа
- EAP - восстановление и заживление
- Hands and lips - руки и губы
- Hydrotenseur -антивозрастной уход
- Intense C - сияние кожи
- Maquillage - декоративная косметика
- Micro - морщины первого уровня
- Multirepair - лифтинг
- Re-sleep - эластичность, ночной уход
- Stretch Mark - растяжки и эластичность
- Sun system - защита от солнца
- Xerolact - сухая и очень сухая кожа
- Xerolact [Atopic] - атопия
- Xerolact [E] - ксератоз, псориаз
- Sensaderm
- Skin-Cap
- Topicrem
- Uriage
- Vichy
- Aqualia Thermal - увлажнение
- Deodorants - дезодоранты
- Dercos - волосы
- Ideal Soleil - защита от солнца
- Idealia - энергия
- Liftactiv - антивозрастной уход
- Liftactiv Flexiteint - тональные средства, лифтинг
- Mineral 89 - гиалуроновая кислота
- Mineral Masks - минеральные маски
- Neovadiol - менопаузы
- Normaderm - жирная кожа, акне
- Nutrilogie - очень сухая кожа
- Purete Thermale - очищение
- Slow Age - антивозврастной уход
- Vichy Homme - мужчины
- Термальная вода Vichy
- Медицинские изделия и приборы
- Аппараты магнитотерапии
- Глюкометры
- Грелки, клизмы, жгуты
- Иглы для диабетиков
- Ингаляторы/небулайзеры и аксессуары
- Иные изделия медицинского назначения
- Ланцеты
- Маски медицинские
- Материалы для УЗИ и ЭКГ
- Морские воды и средства применяемые при заболевания ЛОР органов
- Мочеприемники и катетеры
- Перевязочные материалы и пластыри
- Перчатки медицинские
- Повязки для лечения рубцов
- Пульсоксиметр
- Таблетницы, аптечки
- Термометры
- Тест-полоски
- Тесты для определения беременности и овуляции
- Тонометры и аксессуары
- Шприцы и системы для инфузий
- Экспресс тесты диагностические
- Декоративная косметика
- Косметика для бровей
- Косметика для глаз
- Косметика для губ
- Косметика для лица
- Гигиена
- Гигиенические расходные материалы
- Интимная гигиена
- Наборы косметики
- Товары для детей и родителей
- Гигиенические средства
- Детское питание
- Игрушки для детей
- Товары для малышей
- Товары для мам
- Ортопедия
- Уход за лежачими больными
- Гигиенические пеленки, простыни
- Подгузники для взрослых
- Приспособления по уходу
- Средства по уходу
- Трусы для взрослых
- Урологические прокладки
- Уход за кожей
- Парфюмерия
- Релакс & велнес
- Сексуальное здоровье
- Спорт и фитнес
- Питание
- Уход за полостью рта
- Книги
- Косметика для мужчин
- Сезонная аптечка
- Солнцезащитные средства
- Уход за обувью
- Другое
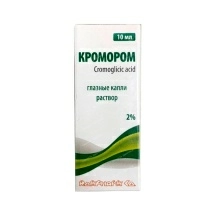
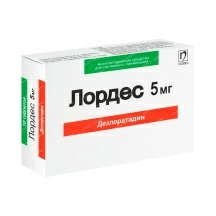
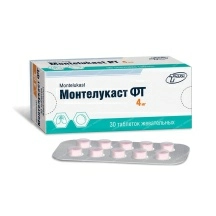
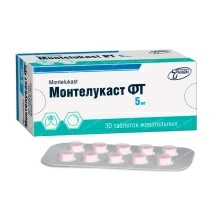
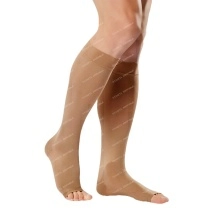
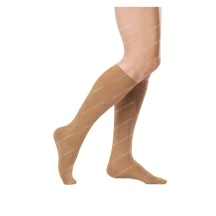
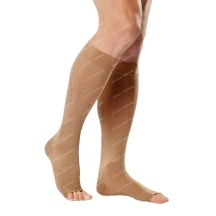
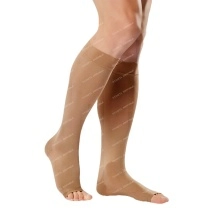
Лекарственные и профилактические средства
ДерматологияЛечение и профилактика грибкаЛечение акнеЛечение ожогов, ран и пролежнейЛечение перхоти и выпадения волосЛечение псориаза и дерматитаУдаление рубцов
Желудочно-кишечный трактЛекарства от тошноты и укачиванияЛекарства при вздутии животаЛекарства при изжогеЛекарства при кишечных расстройствахЛечение язвы и гастритаНормализация кишечной микрофлорыСлабительные средстваСнимающие спазм ЖКТСредства для похуденияСредства для улучшения пищеварения
Женское здоровьеВосстановление микрофлорыГормональная терапияДля нормализации циклаКонтрацепцияПротивогрибковые и антибактериальныеРегуляция лактацииСредства при менопаузе
Костно-мышечная системаДля укрепления костей и суставовЛекарства для лечения подагрыМестные обезболивающие и противовоспалительные средстваМиорелаксанты
Лекарства при заболеваниях глаз и ушейГигиена и лечение ухаЛечение глазных инфекций и воспаленийЛечение сухости и повреждения глаз
Лекарства при простуде и гриппеИммуномодуляторы и противовирусные препаратыЛекарства при боли в горлеЛекарства при кашлеПротивопростудные и жаропонижающиеСредства при насморке
Нервная системаАнтидепрессантыДля лечения никотиновой зависимостиПри нарушениях нервной системыУспокоительные и снотворные
Красота и уход
Уход за волосамиАктиваторы роста волосБезсульфатные шампуни для волосКондиционеры и бальзамы для волосМаски для волосМасла для волосНесмываемый уход за волосамиПилинг для кожи головыПротив выпадения волосСредства от вшейУход за проблемной кожей головыШампуни для волос
Уход за глазамиКорректоры для глазЛифтинг и морщины вокруг глазОтбеливание кожи вокруг глазОтечность вокруг глазПатчи Снятие макияжаУвлажнение и питание кожи вокруг глаз
Уход за лицомАнтивозрастной уходДепиляция лицаДневные кремы для лицаКосметические масла для лицаКремы с SPFМаски для лицаМезороллерыНочные кремы для лицаОтбеливаниеОчищение кожи лицаПилинг и отшелушивание для лицаПитание для кожи лицаСыворотки для лицаУвлажнение кожи лица
Уход за проблемной кожейЛечение акнеЛечение витилигоЛечение куперозаЛечение пигментацииЛечение при розацеиЛечение псориазаСухая и атопическая кожаУход после химиотерапииЧувствительная и склонная к аллергииЭмоленты
Уход за рукамиАнтибактериальные средства для рукМаникюрные принадлежностиОчищение кожиУвлажнение и питание рукУход за ногтями
Уход за теломАнтицеллюлитные средстваДезодоранты для телаДепиляция и бритье телаДополнительное очищение телаЖидкое и твердое мылоКосметические масла для телаКремы с SPFПитание и увлажнение кожиРастяжки кожиРепеллентыСпециальный уход за кожейСредства для ванны и душаСредства для массажаСухая и атопическая кожа
Оптика
Дермакосметика
AveneAntirougeurs - куперозCicalfate - раздражениеCleanance - жирная кожа, акнеCold cream - очень сухая кожаHydrance - увлажнениеPhysiolift - антивозврастной уходTolerance - аллергенная кожаTriAcneal - акнеTrixera - сухая, чувствительная кожаXeracalm - атопияЗащита от солнца AveneОчищение кожиТермальная вода AveneЧувствительная кожа
BABE LaboratoriosBABE Laboratorios - ВолосыBABE Laboratorios - ДетствоBABE Laboratorios - Жирная кожа, акнеBABE Laboratorios - защита от солнцаBABE Laboratorios - СывороткиBABE Laboratorios - уход за лицомBABE Laboratorios - уход за телом
BiodermaAtoderm - атопияCicabio - раздраженная кожаHydrabio - чувствительная, обезвоженная кожаPhotoderm - защита от солнцаSebium - жирная кожа, акнеSensibio - розацея, дерматит
DermedicDermedic BabyDermedic CAPILARTEDermedic CICATOPYDermedic MELUMINDermedic NORMACNEDermedic OILAGEDermedic SUNBRELLADermedio HYDRAIN3 HIALURON
Ducray Ducray - дезодорантDucray - Жирная кожа, акнеDucray - при пигментацииDucray - уход за волосами
ISISPHARMAAQUARUBORIL - очищениеGENESKIN - лифтингGLYCO-A - пилингNEOTONE - пигментацияRUBORIL - чувствительная кожаSENSYLIATEEN DERM - проблемная кожаVITISKIN - регулятор пигментообразования
La Roche-PosayAnthelios - защита от солнцаCicaplast - мультивосстановление кожи Effaclar - жирная кожа, акнеHyalu B5 - увлажнение, против морщинHydraphase - чувствительная, обезвоженная кожаHydreane - увлажнения, чувствительная кожаLa Roche-Posay - ДезодорантыLa Roche-Posay - Очищение лицаLipikar - очень сухая кожа, раздражениеNutritic - очень сухая кожаRedermic - антивозрастной уходRetinol - глубокие морщиныRosaliac - куперозToleriane - сверхчувствительная кожаVitamin C - антивозрастной уходТермальная вода La Roche-Posay
Louis WidmerLouis Widmer - защита от солнцаLouis Widmer - Уход за волосамиLouis Widmer - Уход за лицомLouis Widmer - Уход за теломДезодорантыРемедерм - очень сухая кожаСкин Эпил - жирная кожа, акне
NorevaАКВАРЕВА - увлажнениеАКТИПЮР - чувствительная, проблемная кожа с несовершенствамиАЛЬФА КМ - антивозврастной уходБЕРГАСОЛ ЭКСПЕРТ- солнцезащитная линейкаБЕРГАСОЛ СУБЛИМ - средства для активации загара и защита от солнцаГЕКСАФАН - уход за волосамиКСЕРОДИАН - уход за сухой и очень сухой кожей, склонной к атопииМАТИДИАН - комбинированная кожаНОВЕАН ПРЕМИУМ - антивозврастной уходПСОРИАН - псориазСЕБОДИАН DS - себорейный дерматитСЕНСИДИАН - чувствительная, реактивная кожаСЕНСИДИАН AR - розацеа, куперозЦИКАДИАН - восстанавливающий уходЭКСФОЛИАК - жирная, проблемная кожа с несовершенствами
NovexpertHyaluronic Acid line - разглаживание и антивозрастной уходMagnesium line - чувствительная кожаOmegas line - очень сухая кожа, дерматитPolyphenols line - отбеливаниеPro-collagen line - разглаживание морщинPro-melanin line - пигментация и антивозрастной уходTrio-Zinc line - антиакне и антивозрастной уходVitamin C line - сияние и антивозрастной уход
PharmacerisPharmaceris A - аллергенная кожаPharmaceris E - очень сухая кожаPharmaceris F - тональные флюидыPharmaceris H - волосыPharmaceris M - Уход за кожей во время беременности и кормленияPharmaceris N - капиллярыPharmaceris P - псориазPharmaceris R - розацеаPharmaceris S - солнцезащитный уходPharmaceris T - жирная кожа, акнеPharmaceris V - витилигоPharmaceris W - пигментация
RILASTILAcnestil - жирная кожа, акнеAge Repair - солнцезащитный уход для возрастной кожиAqua - увлажнениеD-clar - пигментацияDaily Care - очищение и демакияжDeliskin RS - куперозDEO - дезодорантDermastil pediatric - детствоDifesa - чувствительня, аллергенная кожаEAP - восстановление и заживлениеHands and lips - руки и губыHydrotenseur -антивозрастной уходIntense C - сияние кожи Maquillage - декоративная косметикаMicro - морщины первого уровняMultirepair - лифтингRe-sleep - эластичность, ночной уходStretch Mark - растяжки и эластичностьSun system - защита от солнцаXerolact - сухая и очень сухая кожаXerolact [Atopic] - атопияXerolact [E] - ксератоз, псориаз
TopicremAK - смешанная и жирная кожаCalm+ гиперчувствительная кожаHydra+ чувствительная кожаUR-10 - очень сухая кожаАД - атопичная кожаАН 3 - антивозрастной уходДетская линия - детствоЦИКА - раздраженная кожаЧувствительная кожа - увлажнение
UriageBariesun - солнцеD.S. - себорейный дерматитDeodorant - дезодорантыБарьедерм - раздражениеИнтимная гигиенаИсеак - жирная кожа, акнеКсемоз - атопия,очень сухая кожаО`Термаль - увлажнениеОчищениеРозельян - купероз, розацеяТермальная вода Uriage
Vichy Aqualia Thermal - увлажнениеDeodorants - дезодорантыDercos - волосыIdeal Soleil - защита от солнцаIdealia - энергияLiftactiv - антивозрастной уходLiftactiv Flexiteint - тональные средства, лифтингMineral 89 - гиалуроновая кислотаMineral Masks - минеральные маскиNeovadiol - менопаузыNormaderm - жирная кожа, акнеNutrilogie - очень сухая кожаPurete Thermale - очищениеSlow Age - антивозврастной уходVichy Homme - мужчиныТермальная вода Vichy
Товары для детей и родителей
Гигиенические средстваГигиена полости носа для детейГигиена полости ртаДетские пеленкиДетские подгузникиДетские репеллентыДетские салфетки, ватные палочкиКремы под подгузникКупание ребенкаМасла для ухода за ребенкомНожницы детскиеПрисыпкаСолнцезащитные средстваСредства по уходу за кожей ребенка
Уход за лежачими больными